生体調節学 久原 篤 研究室
現在の研究内容

動物の温度に対する応答と記憶を明らかにする
みなさんの周りには様々な環境の情報があふれていまして、それらの環境情報は、例えば、光や匂いや空気や温度などで構成されています。 そのなかでも、温度は地球上に必ず存在し、生体の化学反応にも直接影響を与える重要な環境情報ですので、生物の温度に対する応答や適応は生命の維持と繁栄にとってとても重要です。
久原 研究室では、動物がどのように温度を感じて記憶して、環境に対する耐性や馴化、そして適応や進化をおこなっているかをシンプルな実験動物である線虫をつかい研究しています。
これらの研究から、ヒトを含む動物が脳神経系においてどのように感覚や記憶が制御されているのかや、体が温度になれるための体内組織の仕組みや、どのようにして環境に適応や進化してきたかなどの重要な仕組みが明らかになります。
実用面では、私たちの実験系は、ヒトの生体調節に関わる新しい薬の開発にも関わっています。また、神経活動を解析する光学装置を企業と共同で開発しております。
温度耐性に関する研究の背景
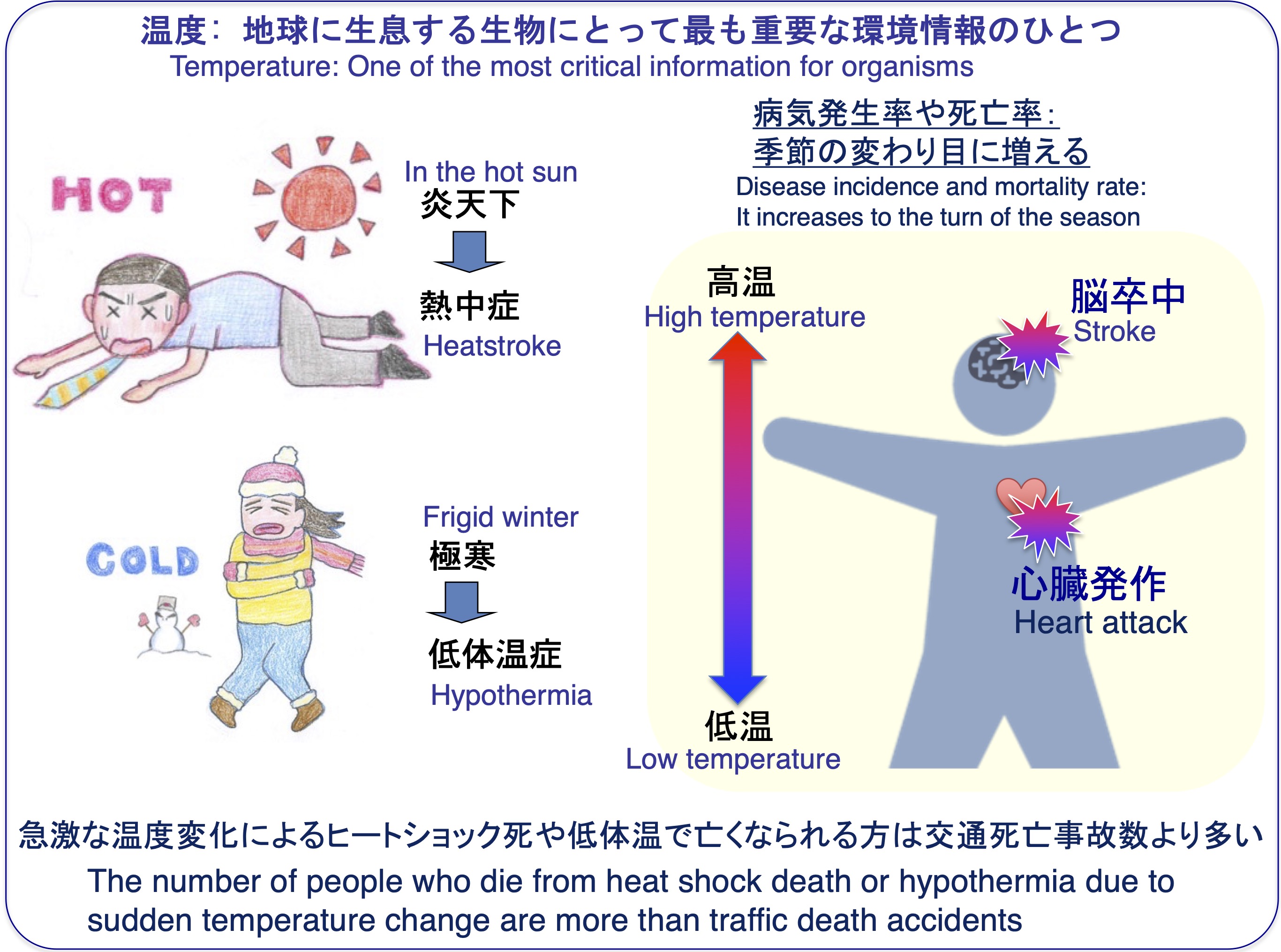
温度は生物が生存していく中で重要な環境因子です。例えば、人間では体温がわずか3℃低下し33℃になると仮死状態になることや、病気の発生率や死亡率は気温変化が大きい時季に増加します。
温度が関わる病気は多数あり、急激な温度変化によるヒートショック死や低体温症が社会問題となっており、これらにより亡くなる方の数は交通事故による死亡数よりも多いという報告があります。
地球規模でも、温暖化や局所的な寒冷化により生物種の3割が絶滅の危機に瀕すると報告されており、生物の温度適応は世界的な課題となっています。
生体が寒さになれることで耐性をもつ機構も、高等動物だけでなく、植物や昆虫など様々な生物でも研究が進められてきています。
低温に対する耐性機構として、植物から昆虫まで共通してみられる現象として、生体膜の不飽和脂肪酸の含有量を増加させ膜の流動性を高め、細胞の凍結を防ぐ機構が知られています。 また,細胞内に低分子量のグリセロールやソルビトールなどの糖アルコールや、トレハロースやグルコースなどの糖を蓄積させ、低温や凍結に対する組織を保護することも半世紀以上前から知られています。
そのような耐性を引き起こす体内変化が知られている一方で、温度の感知から耐性を引き起こすまでの分子情報伝達の過程については未知の点がたくさん残されています。
温度への生体調節に関する分子生理メカニズムを明らかにするために、シンプルな動物である線虫C. エレガンス(Caenorhabditis elegans(C. elegans))を使って解析を行っています。
動物の温度に対する応答と記憶、温度耐性・順化の解析
地球温暖化および局所的な寒冷化は生命の存続にかかわる問題である。当研究室では、線虫C.エレガンスを解析モデルとして、 動物の温度耐性システムに関与する「温度感知」と「温度記憶」、そして「温度耐性・順化」の遺伝子(分子)と組織メカニズムの解明を目指しています。
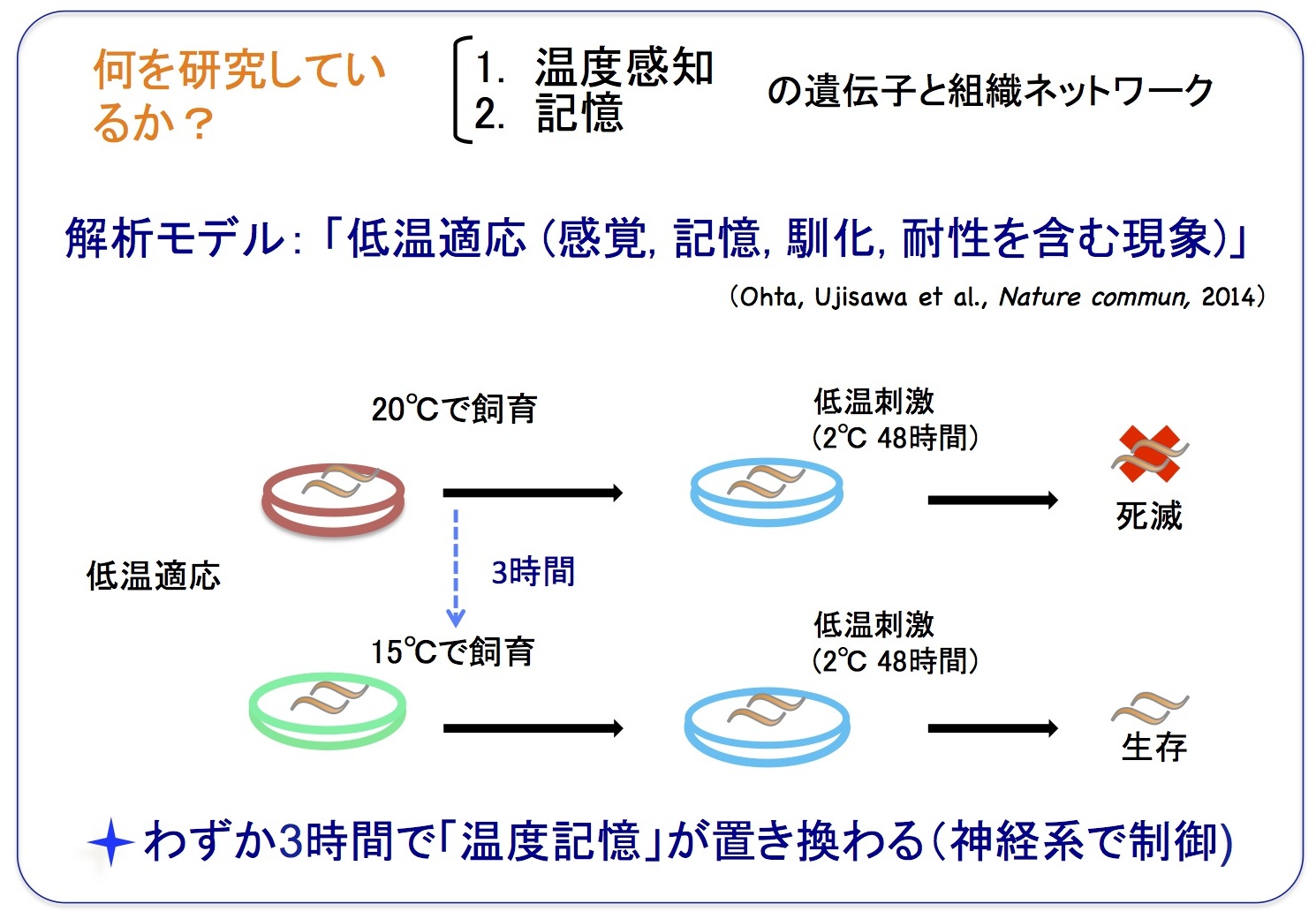
温度行動研究の過程で、線虫の「低温耐性」に気がついた。低温耐性とは、C.エレガンスの野生株系統(イギリスDR)を、20℃で飼育した後に、2℃に移すと死滅してしまいます(20℃→ 2℃: 死滅)が、15℃で飼育した後に2℃に移すと、90%以上の個体が生き残る現象です(15℃→ 2℃: 90%生存)。つまり、線虫は、環境温度の低下に伴い、より低温になれる(馴化や耐性)ように体内で制御していると考えられます。
さらに、20℃で飼育された個体は、わずか3時間15℃に置くことで生存できるようになりました(Ohta, Ujisawa, et al., Nature commun., 2014)。この現象は、神経系において哺乳類の記憶に関わる遺伝子で制御されていることから温度記憶の解析系として使えると考えられます(Motomura et al., PNAS, 2022)。
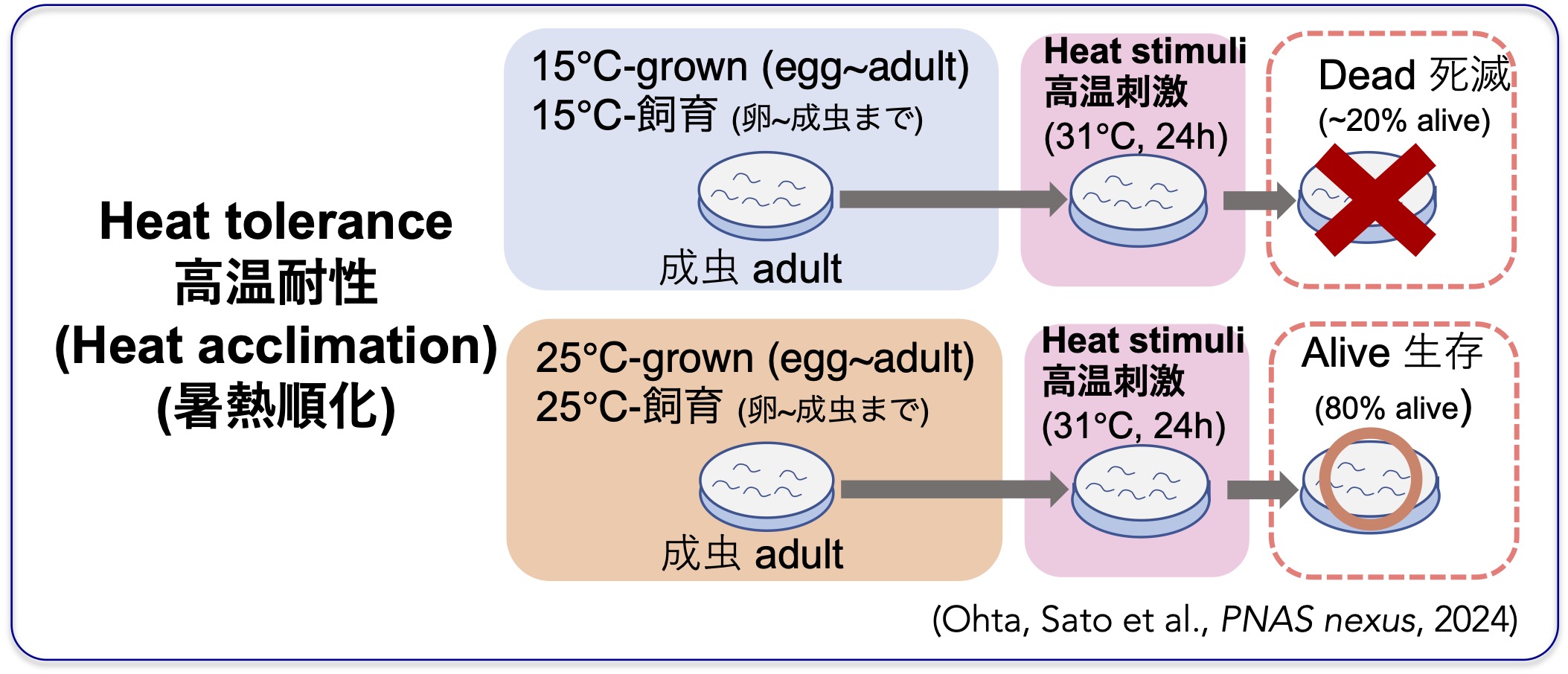
高温耐性や高温になれる暑熱順化も見つかってきました。C.エレガンスの野生株系統(イギリスDR)が、過去の飼育温度に依存して高温耐性を変化させるか調べたところ、15℃で飼育された個体は31℃で死亡し、25℃で飼育された個体は31℃でも生存し、20℃で飼育された個体は半分ほどが生存できることが分かりました(Ohta, Sato et al., PNAS nexus, 2024)。
これらの結果から、高温にさらされた後では、より高い温度に曝されても生存できるようになるという暑熱順化(しょねつじゅんか)を持つことがわかりました。また、高温耐性の獲得や喪失が過去の飼育温度に依存していることが分かりました。
このような低温と高温に対する温度耐性・順化の現象に着目し、温度受容と記憶、そして温度への耐性・順化のに関わる分子機構の解析を行なっています。
温度感知と耐性に関わる遺伝子と組織ネットワーク
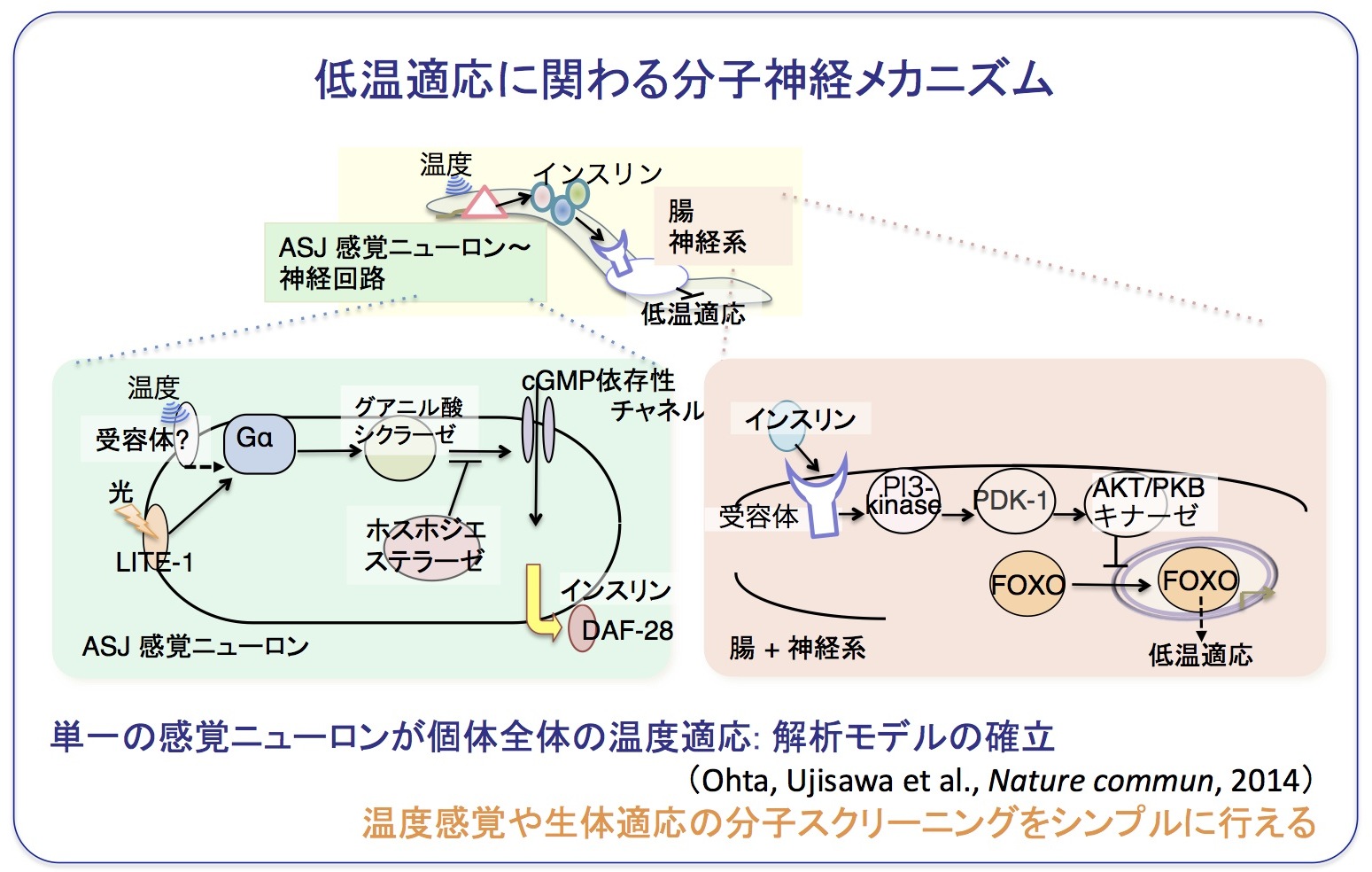
これまでに低温耐性に関わる遺伝子と細胞レベルでの解析をおこない、低温耐性に関わる新たなシステムが見つかってきました(Ohta, et al., Nature commun., 2014)。
具体的には、従来、光やフェロモンを受容することが知られていた感覚ニューロンが温度を受容し、それに応じてインスリンが分泌され、腸などで受容されることで制御されるという、新たなシステムが見つかってきました(Ohta, et al., Nature commun., 2014)。
また、光の感知に関わる遺伝子が温度の感知にも関わっていました(Ujisawa et al., PLOS ONE, 2016)。
以上の解析には、従来の遺伝子変異体の解析だけでなく、神経活動のイメージング解析、DNAマイクロアレイ解析、ガスクロマトグラフィー解析など多面的な解析手法を用いました。
これまでに見つかった温度耐性のシステムを利用することで、未知の温度受容体や、記憶に関わる分子、さらに組織間ネットワークを制御する分子生理機構が明らかになると考え、関連遺伝子の単離を行っています。
(一般+学部生向け:この研究部分に関するテレビや新聞での解説 こちら)
(一般+学部生向け:文部科学省 科研費ニュースでの解説 こちら)
(学部生向け:専門的なダイジェスト記事 こちら(文科省新学術領域 記憶ダイナミズム HP))
(学部生~専門家向け:専門家向けの総説 こちら(比較性理性化学学会 学会誌HP))
Gタンパク質共役受容体(GPCR)が温度を受容し動物の温度適応を調節
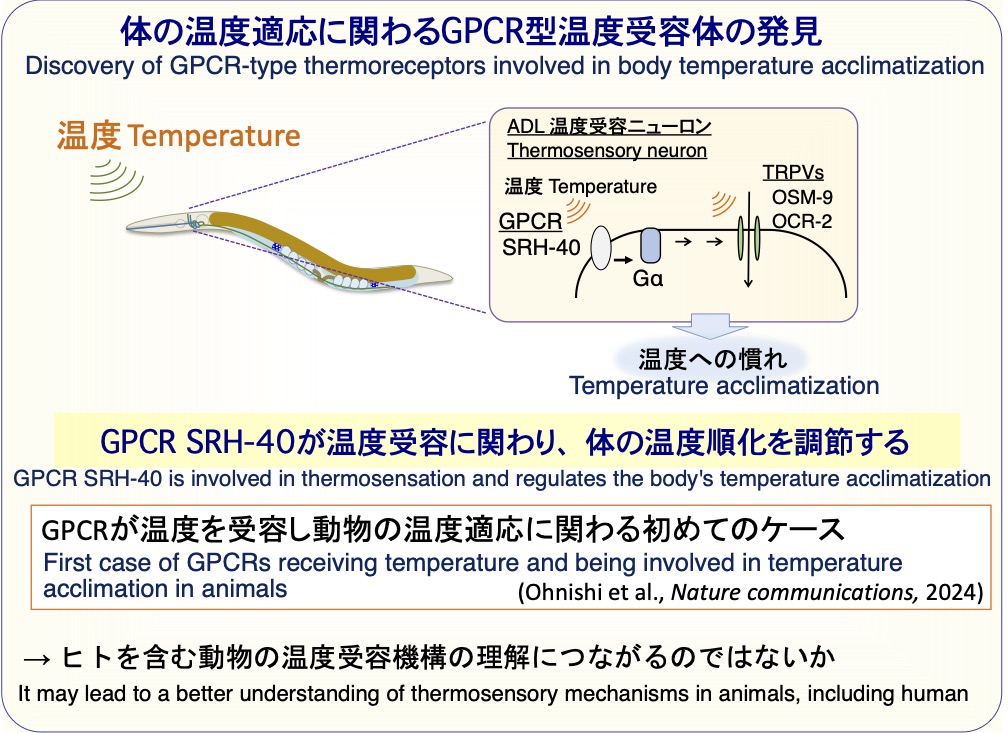
低温耐性に関わる新たな温度受容ニューロンとして、嗅覚ニューロンとして知られていたADLニューロンが見つかってきました(Ujisawa et al., PNAS, 2018)。このADLニューロンでは、ヒトの温度受容体であるTRPVチャネルが温度受容体として機能していました(Ohnishi et al., Scientific reports, 2020)。
ところが、この線虫のTRPVチャネル(OSM-9とOCR-2)はヒトのTRPVチャネルに比べて1/10以下しか温度に反応しませんでした。そのため、TRPV以外の他の温度受容体が存在すると予想しました。そこで、新型温度受容体を同定するための研究を進めました。
その結果、ヒトの目で働く光受容体(ロドプシン)などで知られるGタンパク質共役受容体(GPCR)が、神経細胞で温度を受容し、体の温度への慣れに関わることを発見しました(Ohnishi et al., Nature commun., 2024)。
遺伝子を抑制する技術であるRNA干渉法を用いて、約1000個のGPCRの中から温度順化に関わるGPCRを探索し、温度センサー候補のGPCRとして「SRH-40」を見つけました。 GPCR「SRH-40」を欠損した変異体線虫では温度順化に異常が見られました。さらに、頭部のADL温度受容ニューロンの温度への反応が低下していました。
「SRH-40」を温度上昇に反応しない味覚ニューロン(ASER)に導入したところ、味覚ニューロンが温度に反応するようになりました。さらに、SRH-40を他の生物の培養細胞(S2R+細胞)に導入したところ、温度への反応が見られました。
これらのことから、GPCR「SRH-40」が神経細胞で温度を受容し、線虫個体の温度への慣れを調節することが分かりました。 この研究成果は、GPCRが温度を受容し動物の温度適応に関わる初めてのケースとなりました(Ohnishi et al., Nature commun., 2024)。
体の温度適応に関わる新型の温度受容体の発見です。感覚の分子機構はヒトから線虫まで保存されているため、ヒトの温度受容の理解や温度が関わる疾患の原因解明に繋がることが期待されます。
(学部生~専門家向け:専門的な解説記事はこちら(プレスリリース))
メカノ受容体が温度を感知して体の低温耐性を調節する
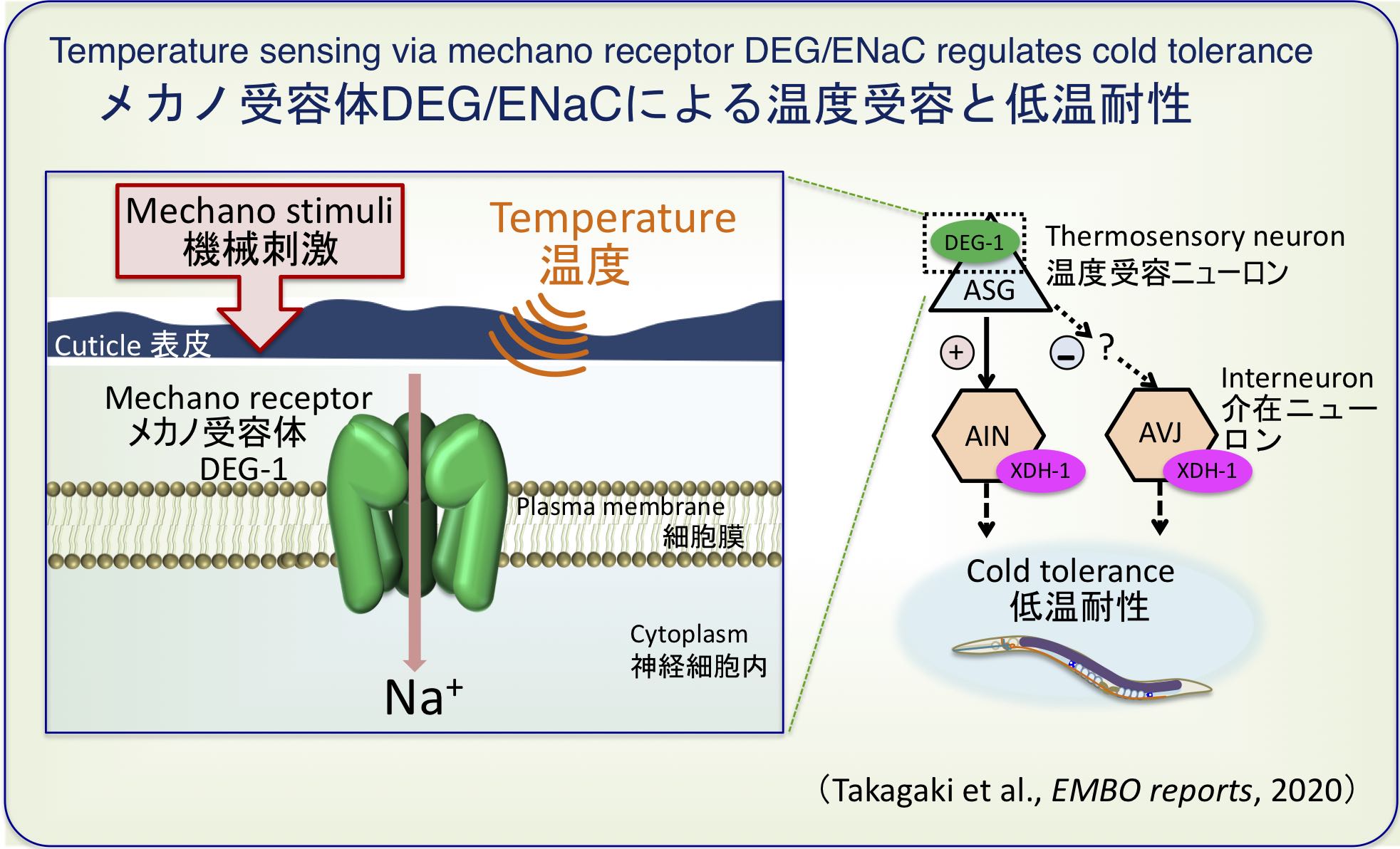
触った時の感触といった機械刺激を受容するメカノ受容体(DEG-1)が温度を受容し低温耐性を調節していました (Takagaki et al., EMBO reports, 2020)。
新たな温度受容ニューロンとしてASGニューロンが見つかり、DEG/ENaC型のメカノ受容体DEG-1がその温度応答に関わっていました。ASG温度受容ニューロンは、下流のAINとAVJ介在ニューロンに情報を伝えることで低温耐性を制御していました。
メカノ受容体DEG-1を味覚ニューロンASEやカエルの卵母細胞に人工的に導入したところ、味覚ニューロンやカエルの卵母細胞が温度上昇に反応するようになりました。さらに、ヒトのメカノ受容体MDEGも温度に反応することが分かりました。
以上の研究から、DEG/ENaC型のメカノ受容体が線虫だけでなくヒトでも温度受容体として働く可能性が考えられ、線虫では低温耐性に関わっていました (Takagaki et al., EMBO reports, 2020)。
将来、ヒトの温度受容の仕組みや、温度による健康障害の原因解明などに役立つと期待されます。
(学部生~専門家向け:専門的な解説記事はこちら(AMED HP))
精子が頭部の温度受容ニューロンをフィードバック制御
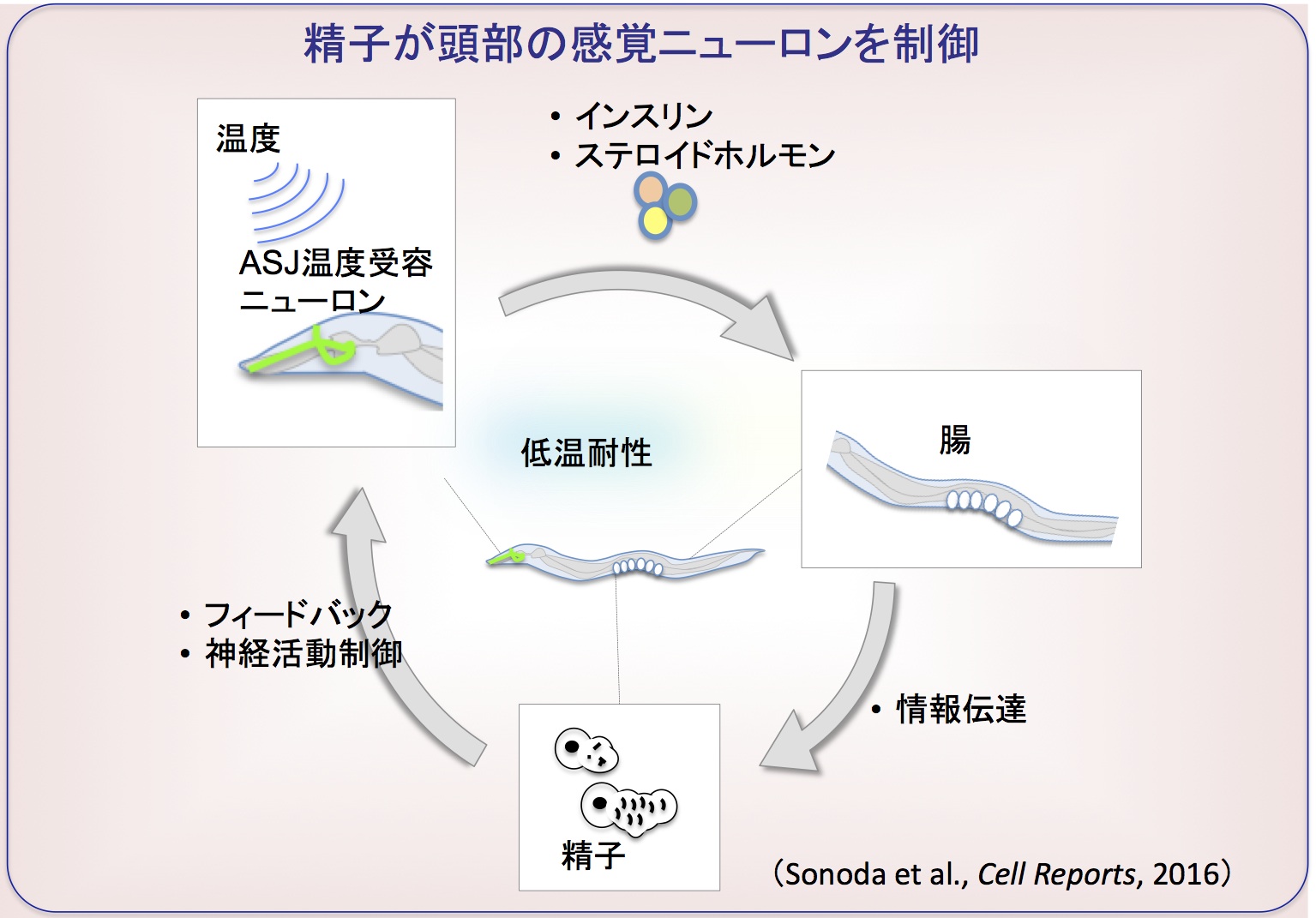
低温耐性を制御する頭部のニューロンの活動が、予想外にも精子によって調節されていることが見つかりました(Sonoda, et al., Cell Reports, 2016)。
低温耐性に関わるさらなる遺伝子を同定するために、腸のインスリン情報伝達系によって制御される遺伝子をDNAマイクロアレイ解析で調べたところ、精子で発現している遺伝子がたくさん見つかった。 それらの精子遺伝子の変異体では、個体の低温耐性が異常でした。
すでに低温耐性に関わることが見つかった頭部の温度受容ニューロンや腸が、精子と情報をやりとりしていることが、遺伝学的エピスタシス解析や定量的PCR解析から見つかり、精子の下流に頭部の温度受容ニューロンが位置するという面白い可能性が考えられました。
そこで、頭部の温度受容ニューロンの神経活動が、精子の異常によって変化するかを、細胞内カルシウムイメージングで測定し、精子が頭部のニューロンを制御していることが見つかりました(Sonoda, et al., Cell Reports, 2016)。
C. エレガンスは下等動物でありるが、これまでに線虫の研究者が多数のノーベル賞を受賞しているように、ヒトと線虫の間に共通する生体調節メカニズムがたくさん見つかっているため、 ヒトとの共通性が見つかる可能性も考えられます。
(一般+学部生向け:この研究部分に関する新聞での解説 こちら)
(一般+学部生向け:文部科学省 科研費ニュースでの解説 こちら)
(学部生~専門家向け:専門的な解説記事はこちら(文科省新学術領域 温度生物学 HP))
筋肉が嗅覚ニューロンに影響を与え体の温度耐性を調節
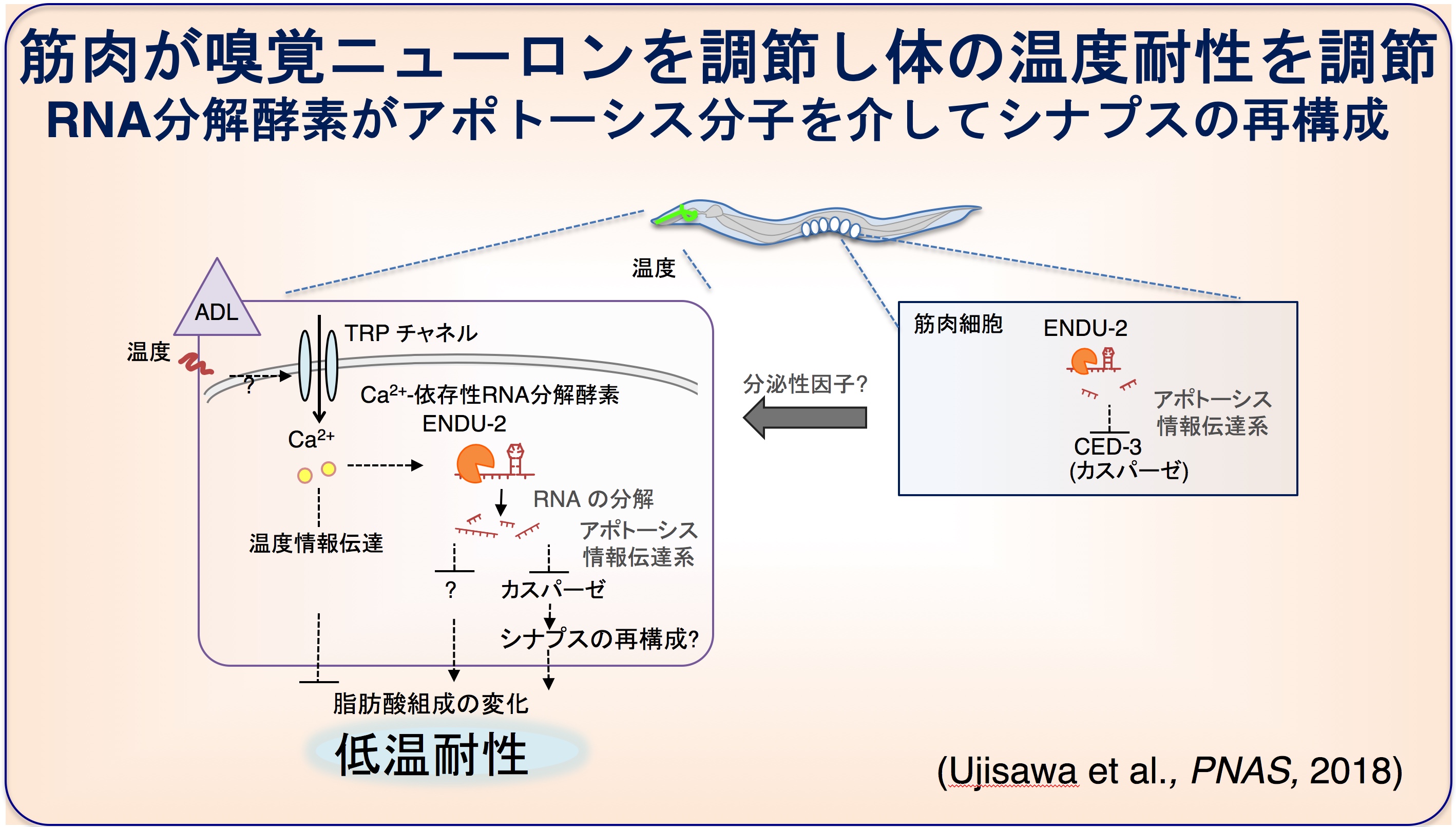
温度刺激依存的に発現変動する遺伝子として、ヒトにおいて詳細な役割が未知であるEndoU(エンドウ)と呼ばれる「カルシウム依存性RNA分解酵素(ENDU-2)」の遺伝子が見つかってきました。
私たちの解析から、線虫のEndoUであるENDU-2が、低温耐性や寿命、産卵数や神経シナプスの刈り込みなど、多様な生命現象に関与していることが分かってきました(Ujisawa et al., PNAS, 2018)。
特に、低温耐性において、ENDU-2が筋肉で働くことで、頭部の1対の嗅覚ニューロン(ADL)の活動を変化させ、体全体の低温耐性を変化させることがわかりました。さらに、ADL嗅覚ニューロンが温度に応答すること、ADL嗅覚ニューロンの中でもENDU-2が神経活動を調節することが見つかりました。
ENDU-2 はニューロン内において、カスパーゼ(CED-3)などのプログラム細胞死(アポトーシス)を誘導する遺伝子の発現を調節し、ニューロンのシナプスの数を適切に調節していました。これらの現象が組み合わさり、低温耐性が調節されていました(Ujisawa et al., PNAS, 2018)。
これまでにヒトと線虫で共通する生体調節メカニズムが多数発見されているため、線虫のENDU-2 が関わる生体現象もヒトでも共通しているかも知れません。
(一般+学部生向け:この研究部分に関する新聞での解説 こちら)
(学部生~専門家向け:専門的な解説記事はこちら(文科省新学術領域 温度生物学 HP))
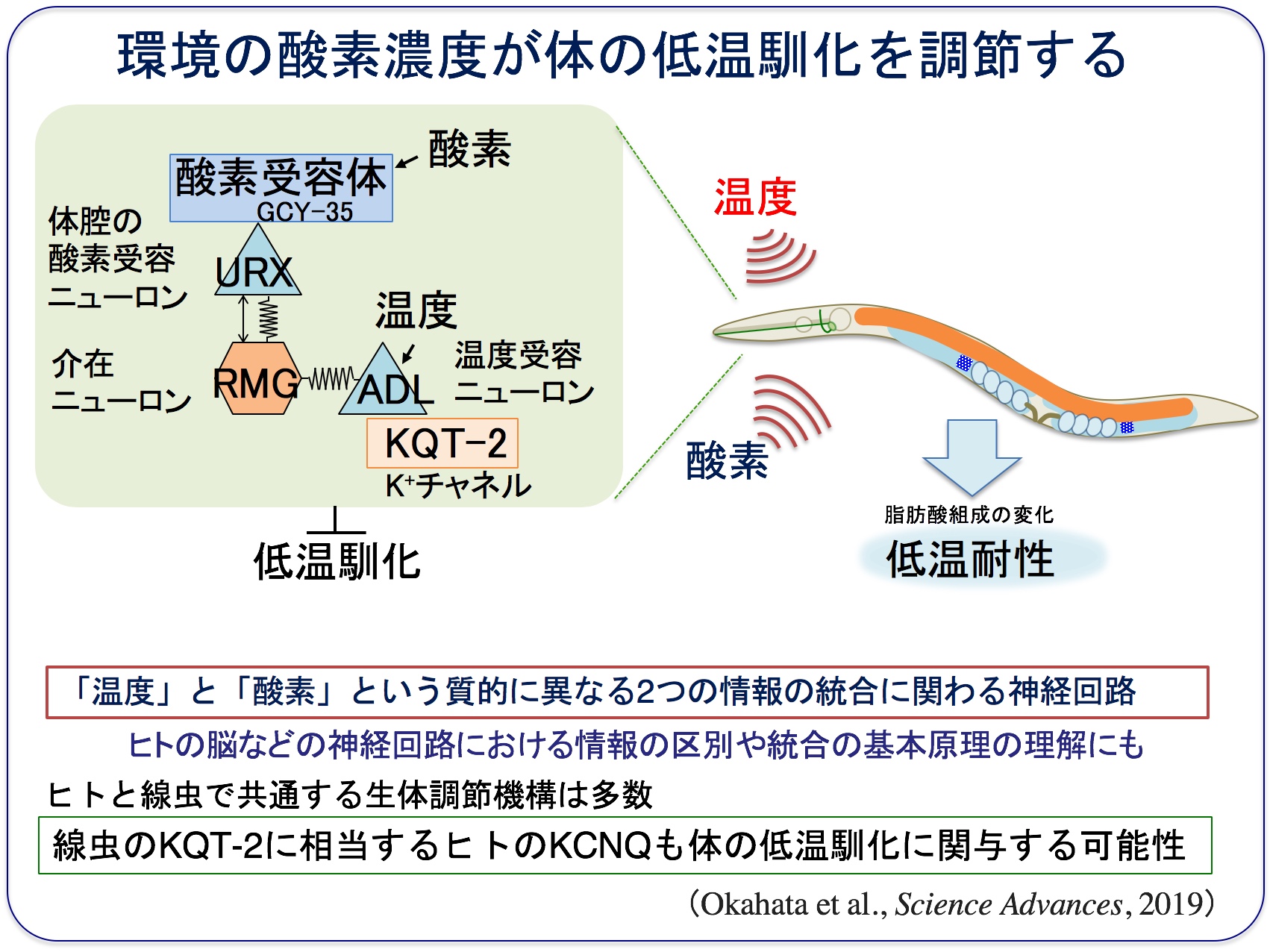
2つの感覚情報を統合・識別するための神経回路の解析
環境の酸素濃度が、からだの低温への馴れ(低温馴化)に関わることが見つかりました(Okahata et al., Science Advances, 2019)。
この現象には、ヒトにおいて心臓病や“てんかん”に関わるカリウムチャネルという神経活動を調節するタンパク質が関わっていました。
具体的には、1)カリウムチャネルKQT-2の変異体が低温馴化の異常を示し、2)それが「飼育空間の大きさ」に影響されること、3)この低温馴化異常の空間依存性には温度受容ニューロン(ADL)が関わっており、温度受容ニューロン(ADL)は別の酸素受容ニューロン(URX)と神経回路を作り、これらが連携して低温馴化を調節していることが見つかりました。
酸素受容ニューロン(URX)は、体液中の酸素濃度を感知する酸素センサーニューロンで、URXの中では酸素受容体タンパク質であるGCY-35が働いています。
今回、温度と酸素という2つの全く異なる感覚情報の統合に関わる神経回路が明らかになりました(Okahata et al., Science Advances, 2019)。
この神経回路を調べていくことで、今後、ヒトの脳内で複雑な情報がどのように統合や識別されるかなどの解析に役立つと考えられます。
(学部生~専門家向け:専門的な解説記事はこちら(文科省新学術領域 温度生物学 HP))
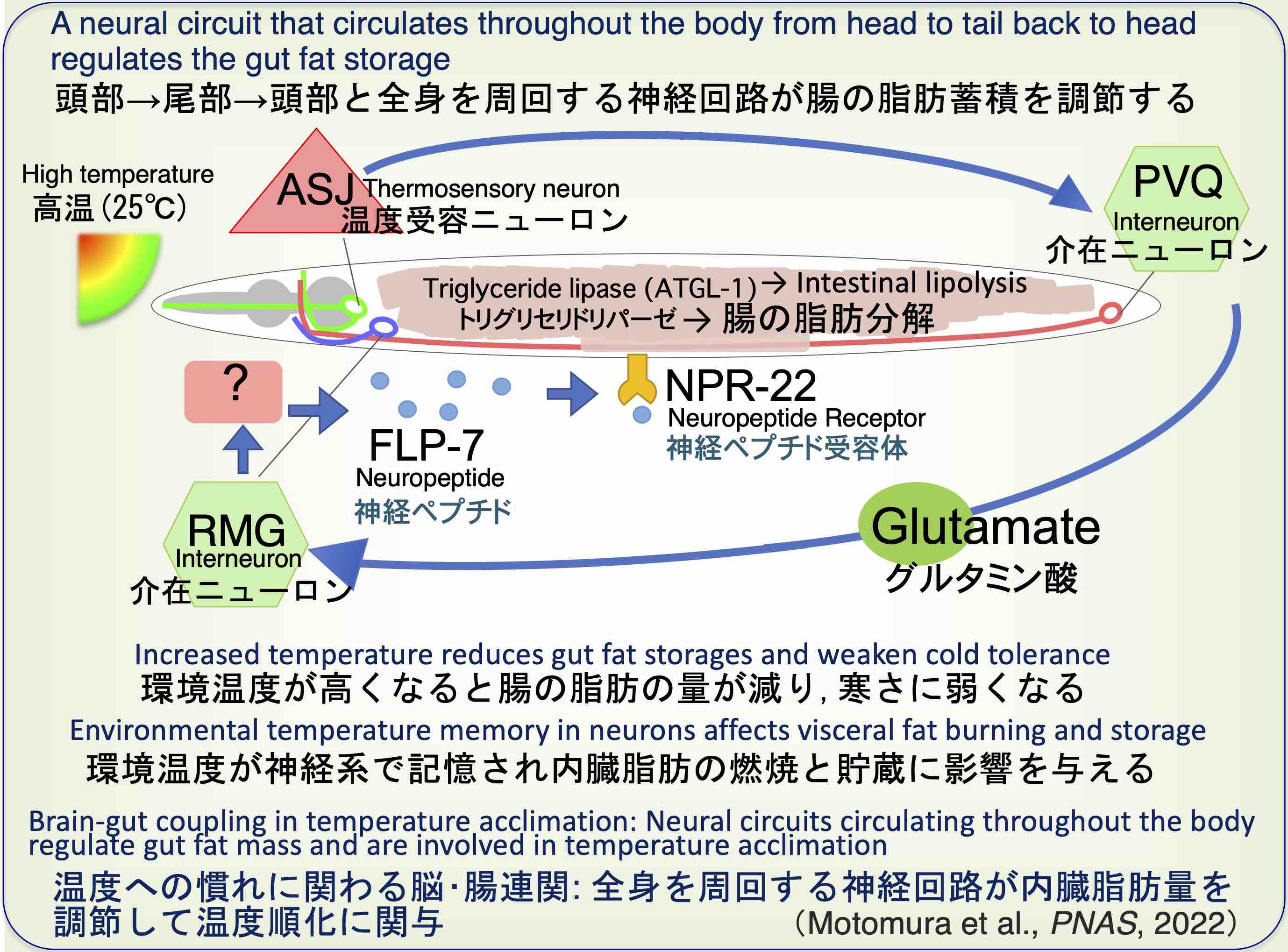
神経系が温度を記憶し内臓脂肪量を調節する:温度への慣れに関わる脳・腸連関
環境の温度変化を記憶した神経細胞が腸に働きかけ、腸内の脂肪量を調整することで体を温度に慣れさせることが見つかりました(Motomura et al., PNAS, 2022)。
「頭部→尾部→頭部」と全身を周回する神経回路が腸に働きかけ、腸内の脂肪量を変化させることで温度への慣れが調節されることが見かりました。
C. エレガンスは一度経験した温度を体内で記憶し、再び同様の温度刺激を受けた際にその温度につよくなることが分かりました。
この温度に馴化する過程にはCREBという哺乳類の記憶に関わる転写因子が関与していました。CREBは、頭部のASJ温度受容ニューロンの温度記憶に関わり、ASJと下流のRMG介在ニューロンにおいて温度馴化に関わっていました。
頭部の温度受容ニューロンASJで受容された温度情報は、尾部に位置するPVQ介在ニューロンに伝達され、さらにPVQから頭部のRMG介在ニューロンへ伝達されていました。
RMGは神経ペプチドFLP-7の分泌を促し、FLP-7は腸にある神経ペプチド受容体NPR-22で受容され、腸内の脂質分解酵素ATGL-1を活性化します。
これにより腸に保持されていた脂肪の分解が進み、高温で飼育されると腸の脂肪量が減り、低い温度では脂肪を使って寒さに慣れている可能性が考えられます(Motomura et al., PNAS, 2022)。
哺乳類の中には冬眠するために秋に脂肪を蓄えるものもおり、今回見つけた新規の脳・腸連関は、高等動物における温度への慣れの理解に繋がるのではないかと期待されます。
(学部生~専門家向け:専門的な解説記事はこちら(プレスリリース))
温耐性現象の多様性の解析
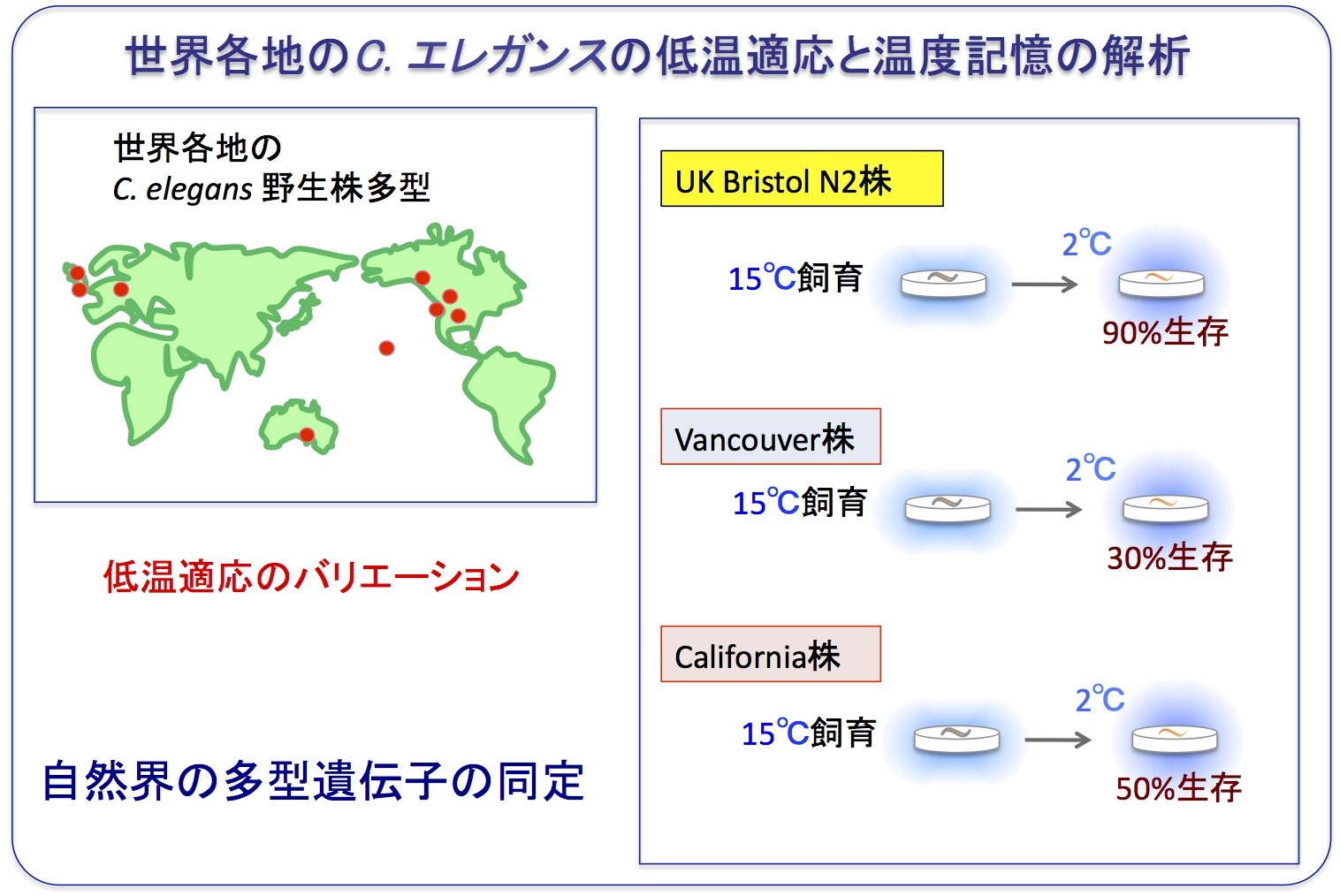
低温耐性は野生株の産地の違いによって大きく異なることが見つかってきたため、低温耐性の多様性現象に着目し、適応や進化やに関わる遺伝子を同定しようとしています(Okahata, et al., JCPB, 2016)。
前述の通り、イギリス産の野生株は、15℃で飼育した後に2℃に移すと、90%以上の個体が生き残りますが(イギリス産: 15℃→ 2℃: 90%生存)。
ところが、ハワイ産の野生株は、15℃で飼育後に2℃に移すと、約40%しか生き残りませんでした (ハワイ産: 15℃→ 2℃: 40%生存)。
また、カリフォルニア産のC.エレガンスにおいても、低温耐性の表現型が異なりました。
さらに、温度への適応スピードの多型も見つかってきたため、次世代DNAシークエンサーと遺伝学的解析を組み合わせ、温度順化や記憶の多型に関わる遺伝子の単離を目指しています。
現在までに、低温耐性や低温順化の多様性を示す様々な系統の全ゲノム配列を決定し、多様性を決める遺伝子の候補が見つかってきました。
これらの研究は、地域の気温の違いと、動物の温度適応の多様性を理解するモデル実験系になると考えられます。
植物と動物に共通する高温耐性の遺伝子
地球温暖化や局所寒冷化による食糧危機に貢献できる高温や低温に強い家畜や農作物の開発に向けて、線虫とシロイヌナズナを用いて、「動物と植物に共通した高温・低温耐性の仕組み」の研究を行っています。
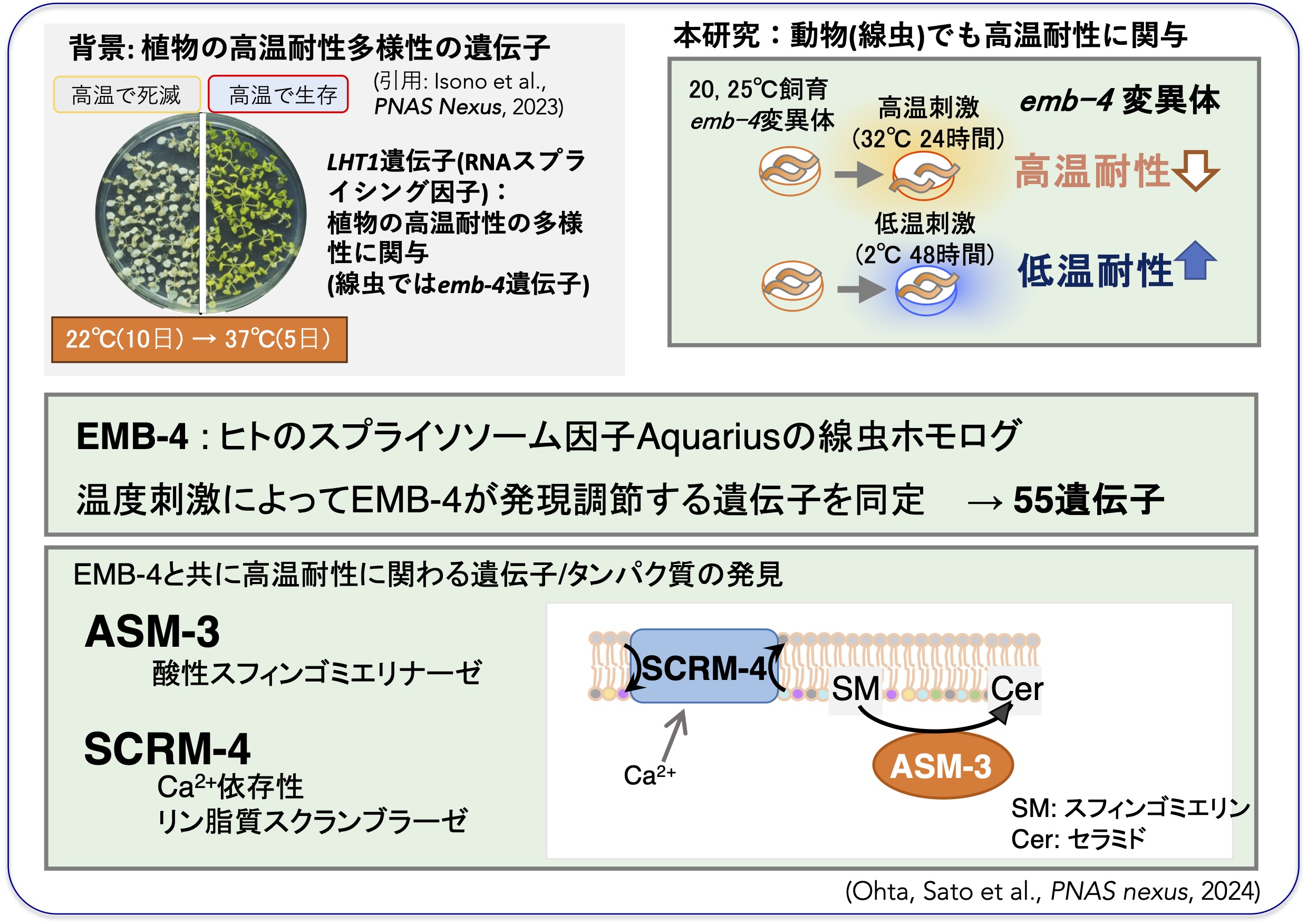
共同研究を行っている太治教授らの解析から、世界各地に存在する多様なシロイヌナズナの高温耐性を強くする遺伝子として、RNAスプライシングの制御因子であるLHT1遺伝子が見つかりました(Isono et al., PNAS nexus, 2023)。
私たちは、この植物のLHT1遺伝子が線虫ではemb-4遺伝子であること、emb-4変異体の高温耐性は野生株よりも弱く、逆に低温耐性は野生株よりも強くなっていることを見つけました(Ohta, Sato et al., PNAS nexus, 2024)。
RNAシーケンシング解析から、スプライシング制御因子であるEMB-4が調節する遺伝子として、脂肪酸代謝に関わる酸性スフィンゴミエリナーゼや生体膜の局所構造に関わるリン脂質スクランブラーゼを見つけ、それらの変異体線虫では高温耐性が強くなりました。
このように、動物と植物に共通した高温耐性の遺伝子が見つかりました。emb-4類似遺伝子は、ヒトから植物まで存在するため、高温に強い家畜や農作物の開発に繋がることを期待しています。
(学部生~専門家向け:専門的な解説記事はこちら(プレスリリース))
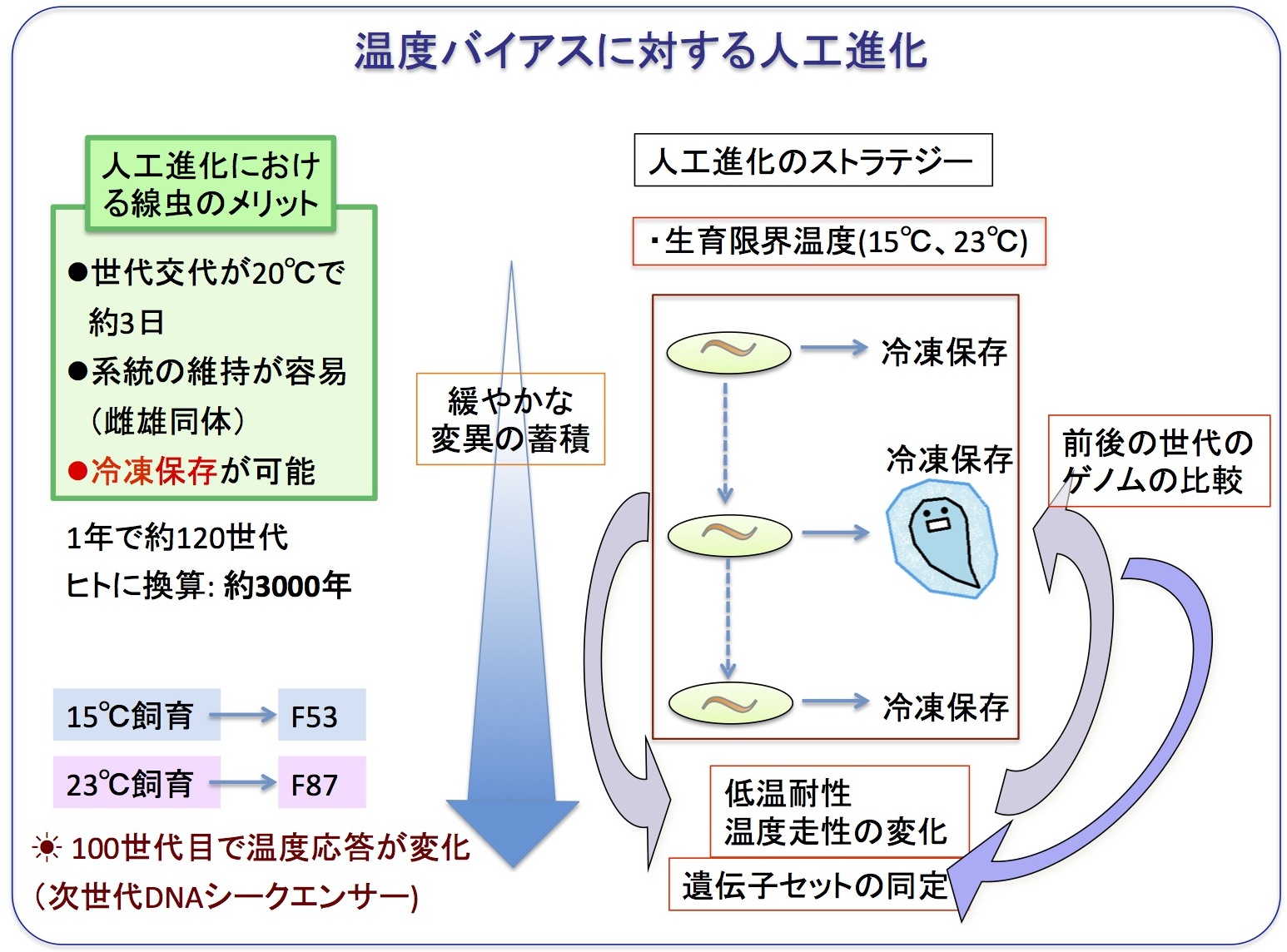
温度環境に対する人工進化
環境の温度変化に対して、動物がどのように適応し進化をとげ、種の多様性を獲得するのかをゲノムレベルで明らかにする研究にも取り組んでいます。
具体的には、平均気温が約20℃のイギリス(Bristol)産のC. elegansを、連続した継代が可能な限界温度の上下点である23℃や15℃で、15年以上かけて飼育し続けています。
線虫は、1世代が2.5~7日であるため、10年間で約1500世代、ヒトに換算すると約5万年に相当する人工進化が期待されます。
定期的に、系統を冷凍保存し、次世代DNAシークエンサーが安価で利用できるようになって来ましたので、そろそろ冷凍保存から起こし、ゲノムDNAを解読してを自然変異を同定したいと計画しています。
すでに約1000世代まで系統維持ができました。約500世代目において、表現型の変化が観察されています。
変異の推移から、将来の地球温暖化による生態における動物の適応と進化を予測できるかもしれません。
線虫は世代交代が3日と早く、毎世代ごとに容易に凍結保存が可能であることがメリットになります。
線虫を実験系として使用するメリットは神経回路がすべて明らかになっていることなどたくさんありますが、おそらく100年後には、他のモデル動物の幾つかでもすべての回路が同定されているものがあると考えられます。
しかし、「世代交代が早い」と「凍結保存できる」という物理的な利点は、時間が経過しても普遍的であると考えられるため、そのメリットを最大に生かそうと思います。
体の低温耐性を強くする薬剤の同定
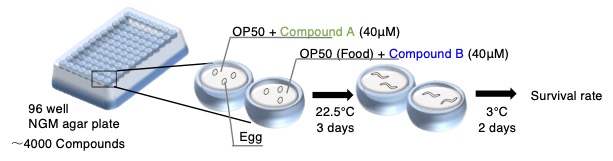
体の低温耐性を強くする薬剤の開発に向けた研究も行っています。
武田薬品工業(株)との共同研究で、約4000種類の薬剤を使い、C. elegansの低温耐性を強くする薬剤を見つけ出すスクリーニングを行いました。その結果、抗がん剤として知られるレプトマイシンBとカンプトテシンをC. elegansに投与することにより、低温耐性が増強されることが分かりました(Okahata et al., Scientific reports, 2024)。
レプトマイシンBあるいはカンプトテシンをC. elegansに投与すると、ストレス応答因子などの遺伝子の発現量が変化し、そのストレス応答遺伝子の変異体では低温耐性異常がみられました。これまでに、腸が低温耐性に関わることを報告しており、レプトマイシンBとカンプトテシンは腸に指令を出す細胞で低温耐性に影響を与えていることが示唆されました(Okahata et al., Scientific reports, 2024)。
線虫を用いることで、短期間で安価に、体の低温耐性に関わる薬剤のスクリーニングを行う実験系を確立しました。従来は抗がん剤として知られている薬剤が、体に低温耐性を獲得させることができました。 C. elegansを用いた効率的な実験系は武田薬品工業(株)と共に立ち上げたもので、過度の低温に曝露された重篤患者を輸送する際の延命治療などに役立つ新薬の開発などに活かされる可能性があると期待されます。
また、これまでに当初は別の治療を目的として開発された薬剤が、別の病気の治療に役立っていることが近年増えております。例えば、スルピリドは発見時は胃薬でしたが、抗うつ剤としても使用されております。既知の薬剤を網羅的にスクリーニングすることで、体の低温耐性を強くする薬剤がさらに見つかる可能性があります。
(学部生~専門家向け:専門的な解説記事はこちら(プレスリリース))
今後の展望と進行中の解析
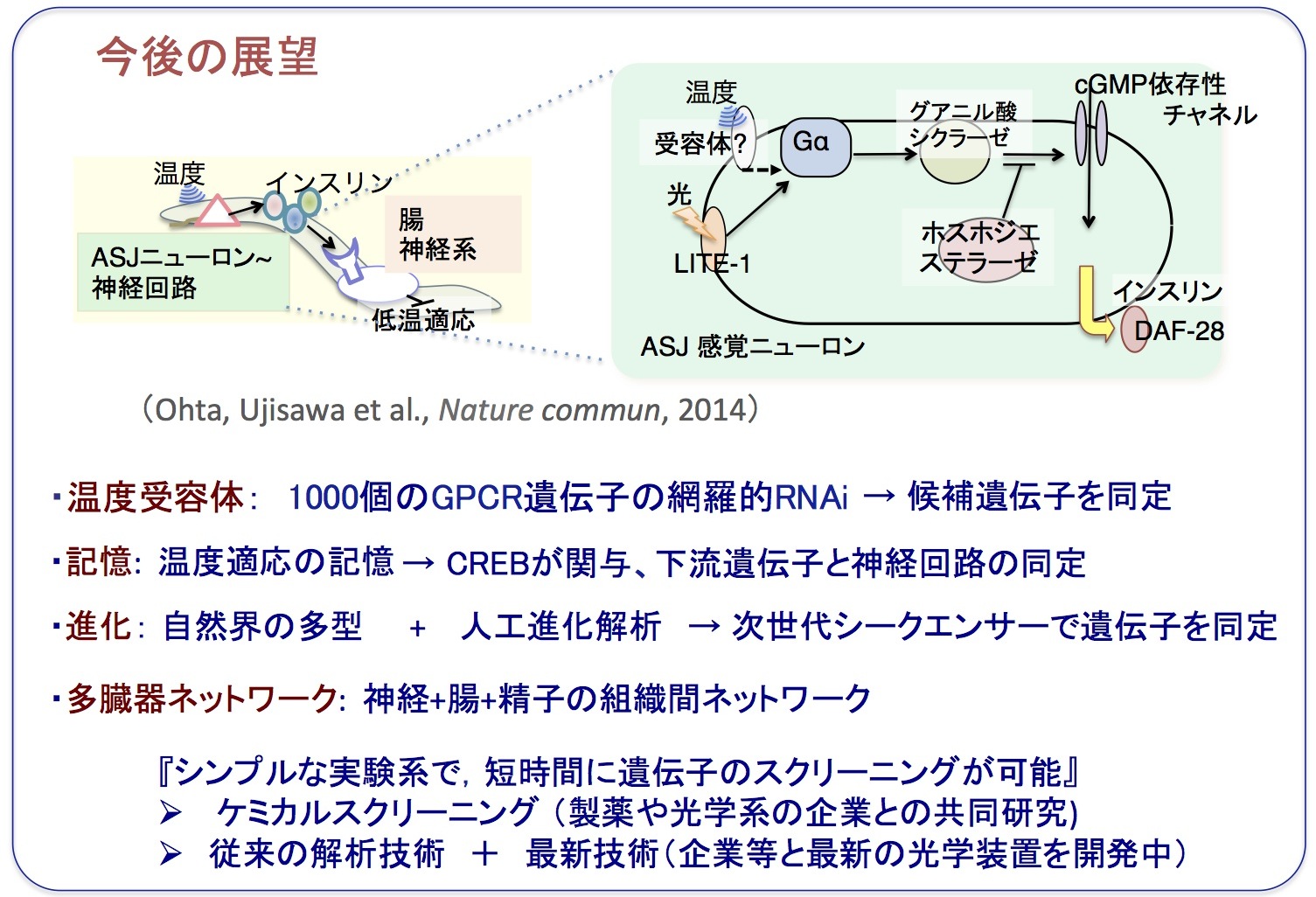
・新規の温度受容体の単離解析: 網羅的RNAiスクリーニングとカルシウムイメージングを組み合わせて行っている。ヒトの未知の温度受容体の同定も目指しています。
・低温死の原因を探る: 低温で死ぬ際にどのような分子が働くかを調べています。遺伝子によって制御される細胞死との関係が見つかってきました。
・記憶の解析: 哺乳類の記憶に関わる転写因子の関与が見つかってきたため、その下流遺伝子の同定と関連する神経回路の同定を行っています。
・多様性と進化: 既に単離した新規変異体や、多型株、および人工進化系統に関しては、次世代DNAシークエンサーを使い、遺伝子の同定を行っています。
・多臓器ネットワーク: 新たに関与が見つかった組織を含めた、体内組織ネットワークの制御機構を内分泌の観点からも解析しています。
・線虫の温度適応の実験系は、非常にシンプルであるため、短時間にハイスループットで温度応答や記憶に関わる遺伝子のスクリーニングが可能である。このメリットを活かし、ケミカルスクリーニングを行っています。
また、神経情報処理の解析系としても便利であるため、企業との光学機器の共同開発にも取り組んでいます。